کاتالیزورهای نوری و الکتروشیمیایی: دو ستون اصلی انقلاب انرژیهای پاک
مقدمه
کاتالیز به عنوان هسته اصلی شیمی مدرن، همواره در حال تحول بوده است. در حالی که کاتالیزورهای حرارتی در بسیاری از صنایع مسلط بودهاند و امکان تولید انبوه مواد شیمیایی و سوختها را فراهم کردهاند، چالشهای ذاتی این روشها، به ویژه مصرف بالای انرژی و تولید آلایندههای جانبی، نیاز مبرمی به جایگزینهای کارآمدتر ایجاد کرده است. نیاز روزافزون به کاهش مصرف انرژی و تولید محصولات جانبی غیرمضر (شیمی سبز)، توجه را به سمت منابع انرژی پاک برای فعالسازی واکنشها معطوف کرده است. در این میان، کاتالیزورهای نوری (Photocatalysts) و الکتروشیمیایی (Electrocatalysts) به عنوان دو رویکرد پیشرو در این زمینه ظهور کردهاند که پتانسیل دگرگون کردن صنایع تولید انرژی و شیمیایی را دارند. این دو حوزه، استفاده هوشمندانه از انرژیهای تجدیدپذیر – نور خورشید و الکتریسیته تجدیدپذیر – را برای انجام تبدیلهای شیمیایی دشوار، بدون نیاز به حرارت زیاد یا واکنشدهندههای خطرناک، ممکن میسازند.
بخش اول: کاتالیزورهای نوری (Photocatalysis) - بهرهگیری از نور خورشید
کاتالیز نوری فرآیندی است که در آن یک کاتالیزور با جذب فوتونهای نور (معمولاً نور خورشید یا نور مصنوعی) فعال شده و انرژی لازم برای شروع واکنش شیمیایی را فراهم میکند. این فناوری مستقیماً از انرژی خورشیدی برای انجام واکنشهای شیمیایی استفاده میکند، که آن را به یک راهکار بالقوه برای کربنزدایی و تولید سوختهای پاک تبدیل میکند.
مکانیسم کلیدی فعالسازی نوری
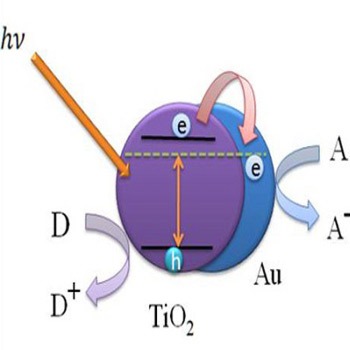
فعالیت کاتالیزورهای نوری اغلب بر مبنای نیمههادیها استوار است. مکانیسم کلی به شرح زیر است:
-
جذب فوتون: کاتالیزور نوری (نیمههادی) یک فوتون با انرژی ($E = h\nu$) جذب میکند که انرژی آن بزرگتر یا مساوی با شکاف باند ($E_g$) ماده باشد. [ E \ge E_g ]
-
تولید زوج الکترون-حفره: این جذب انرژی باعث میشود یک الکترون از نوار ظرفیت (Valence Band - VB) به نوار هدایت (Conduction Band - CB) جهش کند: [ \text{Photocatalyst} + h\nu \rightarrow e^- (\text{CB}) + h^+ (\text{VB}) ]
-
فعالسازی شیمیایی: الکترون آزاد در نوار هدایت و حفره مثبت باقیمانده در نوار ظرفیت، دو گونه فعال اصلی هستند که میتوانند با مولکولهای واکنشدهنده (مانند آب، دیاکسید کربن یا آلایندههای آلی) برهمکنش کنند و واکنشهای ردوکس را کاتالیز نمایند.
چالش اصلی در فوتوکاتالیز: برای کارایی بالا، کاتالیزور باید بتواند در ناحیه طیف مرئی خورشید (که حدود 45% از انرژی خورشیدی را تشکیل میدهد) جذب داشته باشد، در حالی که بسیاری از نیمههادیهای سنتی مانند $\text{TiO}_2$ عمدتاً در ناحیه فرابنفش کار میکنند.
مواد کلیدی در فوتوکاتالیز
دیاکسید تیتانیوم ($\text{TiO}_2$)
$\text{TiO}_2$ پرکاربردترین فوتوکاتالیست است که به دلیل ویژگیهای زیر مورد توجه است:
-
پایداری شیمیایی و حرارتی بالا: در برابر شرایط محیطی مقاوم است.
-
قیمت پایین و فراوانی: تیتانیوم مادهای فراوان است.
-
سمیت ناچیز: برای کاربردهای محیط زیستی ایدهآل است.
-
چالش: شکاف باند آن حدود 3.0 تا 3.2 الکترونولت است (بسته به فاز آناتاز یا روتایل)، به این معنی که فقط نور با طول موج کمتر از 400 نانومتر (فرابنفش) را جذب میکند، در حالی که نور خورشید رسیده به سطح زمین دارای بخش بسیار کمی از این انرژی است.
کاتالیزورهای جاذب نور مرئی
برای بهرهگیری حداکثری از طیف خورشید، تحقیقات به سمت مواد با شکاف باند کوچکتر هدایت شدهاند:
-
کاتالیزورهای مبتنی بر نیتریدها: مانند نیترید گالیم ($\text{GaN}$) یا نیترید کروم ($\text{CrN}$)، که میتوانند در ناحیه مرئی فعال شوند.
-
ترکیبات د د-بلوک و پروسکایتها: موادی مانند سولفید کادمیوم ($\text{CdS}$) و فوتوکاتالیستهای پایه اکسیدهای فلزی دوپ شده (Doped Metal Oxides).
کاربردهای اصلی فوتوکاتالیز
1. تصفیه محیط زیست (Oxidation Advanced Processes - AOPs)
کاتالیز نوری یک روش اکسیداسیون پیشرفته است که برای تخریب آلایندههای آلی مقاوم در آب و هوا استفاده میشود. حفرههای تولید شده توسط نور، رادیکالهای هیدروکسیل ($\cdot \text{OH}$) بسیار قوی تولید میکنند که قادر به اکسید کردن تقریباً هر ترکیب آلی هستند:
[ \text{H}_2\text{O} + h^+ \rightarrow \cdot \text{OH} + \text{H}^+ ] این رادیکالها آلایندهها (مانند رنگها، داروها و آفتکشها) را به ترکیبات سادهتر مانند $\text{CO}_2$ و $\text{H}_2\text{O}$ تجزیه میکنند.
2. تولید هیدروژن خورشیدی (Solar Hydrogen Production)
یکی از جذابترین کاربردها، استفاده مستقیم از انرژی خورشید برای شکافت مولکولهای آب (Photocatalytic Water Splitting) به هیدروژن و اکسیژن است:
[ 2\text{H}_2\text{O} + \text{Energy (Sunlight)} \xrightarrow{\text{Photocatalyst}} 2\text{H}_2 + \text{O}_2 ] این فرآیند، تولید هیدروژن (سوخت پاک) را بدون نیاز به تجهیزات الکترولایزر گرانقیمت یا شبکه برق امکانپذیر میسازد.
3. کاهش دیاکسید کربن ($\text{CO}_2$ Reduction)
تبدیل دیاکسید کربن جذب شده به سوختهای ارزشمند مانند متانول ($\text{CH}_3\text{OH}$) یا متان ($\text{CH}_4$) با استفاده از فوتونها، یک استراتژی بالقوه برای کربنزدایی و ایجاد اقتصاد چرخشی کربن است.
بخش دوم: کاتالیزورهای الکتروشیمیایی (Electrocatalysis) - کنترل با پتانسیل
الکتروکاتالیز شامل فرآیندهایی است که در آن واکنشهای شیمیایی توسط جریان یا پتانسیل الکتریکی کنترل شده در سطح یک الکترود (کاتالیزور) تحریک میشوند. این فرآیندها پایه و اساس فناوریهای ذخیره و تبدیل انرژی مدرن هستند، زیرا امکان کنترل دقیق نرخ واکنش را از طریق تنظیم ولتاژ اعمال شده فراهم میکنند.
نقش کاتالیزور الکتروشیمیایی
کاتالیزور الکتروشیمیایی (الکتروکاتالیست) بر روی سطح الکترود قرار میگیرد و وظیفه اصلی آن کاهش انرژی فعالسازی لازم برای انتقال الکترون بین گونههای شیمیایی در محلول و سطح الکترود است. این کاهش انرژی فعالسازی، منجر به افزایش چشمگیر سرعت واکنش و کاهش ولتاژ مورد نیاز برای انجام فرآیند میشود.
معادله کلی واکنش الکتروشیمیایی:
[ \text{Reactant} + n e^- \xrightarrow{\text{Electrocatalyst}} \text{Product} ] که در آن $n$ تعداد الکترونهای منتقل شده است.
واکنشهای حیاتی در الکتروشیمی انرژی
سه واکنش اصلی در قلب فناوریهای تبدیل و ذخیره انرژی مبتنی بر الکتروشیمی قرار دارند:
1. واکنش کاهش اکسیژن (Oxygen Reduction Reaction - ORR)
این واکنش کاتدی اصلی در سلولهای سوختی است، جایی که اکسیژن (یا هوا) با الکترونها برای تولید آب واکنش میدهد. این فرآیند باید بسیار سریع باشد تا تلفات توان سلول به حداقل برسد.
[ \text{O}_2 + 4\text{H}^+ + 4e^- \xrightarrow{\text{Catalyst}} 2\text{H}_2\text{O} ]
2. واکنش تکامل هیدروژن (Hydrogen Evolution Reaction - HER)
این واکنش کاتدی در فرآیند الکترولیز آب است، جایی که پروتونها (در محیط اسیدی) الکترون دریافت کرده و گاز هیدروژن تولید میکنند.
[ 2\text{H}^+ + 2e^- \xrightarrow{\text{Catalyst}} \text{H}_2 ]
3. واکنش تکامل اکسیژن (Oxygen Evolution Reaction - OER)
این واکنش آندی در الکترولیز آب است، که در آن آب اکسید شده و اکسیژن تولید میشود. OER معمولاً از نظر سینتیکی کُندترین و نیازمند بالاترین پتانسیل اضافی (Overpotential) است و اغلب به قویترین کاتالیزورها نیاز دارد.
[ 2\text{H}_2\text{O} \rightarrow \text{O}_2 + 4\text{H}^+ + 4e^- ]
مواد کلیدی در الکتروکاتالیز
مواد مبتنی بر فلزات نجیب (PGMs)
در حال حاضر، فلزاتی مانند پلاتین (Pt) به عنوان بهترین کاتالیزور برای ORR در سلولهای سوختی هیدروژن-اکسیژن شناخته میشوند. همچنین، ایریدیوم ($\text{Ir}$) و روتنیم ($\text{Ru}$) به عنوان کارآمدترین کاتالیزورها برای OER در محیطهای اسیدی عمل میکنند.
مشکل: قیمت بسیار بالا و ذخایر محدود این فلزات مانع اصلی برای مقیاسپذیری جهانی آنها است.
کاتالیزورهای مبتنی بر فلزات غیر نجیب (NPMCs)
پژوهشهای گستردهای بر روی جایگزینی فلزات گرانبها با مواد فراوانتر متمرکز شدهاند. این مواد اغلب شامل:
-
ترکیبات فلزی چند جزئی (Alloys): مانند آلیاژهای نیکل-آهن یا کبالت-نیکل که در محیطهای قلیایی برای OER بسیار فعال هستند.
-
کربنهای نانو ساختار یا فلزات نانوذرهای: مانند نانوذرات کبالت یا آهن که به صورت پراکنده بر روی سطوح کربنی پشتیبانی میشوند تا کارایی آنها افزایش یابد.
کاربردهای کلیدی الکتروکاتالیز
-
سلولهای سوختی (Fuel Cells): تبدیل کارآمد انرژی شیمیایی هیدروژن و اکسیژن به الکتریسیته با بازدهی بالا و تنها محصول جانبی آب.
-
الکترولیز آب برای تولید هیدروژن سبز: استفاده از برق تولید شده از منابع تجدیدپذیر (خورشیدی فتوولتائیک، بادی) برای شکافت آب و تولید هیدروژن به عنوان حامل انرژی پاک.
-
باتریها و ابرخازنها: الکتروکاتالیستها در الکترودهای باتریهای پیشرفته (مانند باتریهای لیتیوم-هوا) برای تسریع سینتیک شارژ و دشارژ و بهبود طول عمر آنها حیاتی هستند.
بخش سوم: همپوشانی و آینده - فوتوالکتروکاتالیز (Photoelectrocatalysis)
برای دستیابی به بالاترین کارایی تبدیل انرژی، محققان به ترکیب مزایای هر دو حوزه نوری و الکتروشیمیایی روی آوردهاند. فوتوالکتروکاتالیز (PEC) سیستمی است که در آن یک الکترود نیمههادی به عنوان کاتالیزور نوری عمل کرده و در عین حال، یک پتانسیل الکتریکی خارجی نیز به آن اعمال میشود.
مزایای ترکیب نوری و الکتریکی
-
بهبود جداسازی بار: در فوتوکاتالیز خالص، زوج الکترون-حفره ممکن است قبل از رسیدن به سطح، با هم ترکیب (Recombine) شوند و انرژیشان تلف شود. اعمال یک پتانسیل الکتریکی خارجی (حتی یک ولتاژ کوچک) یک میدان داخلی ایجاد میکند که الکترونها را به سمت کاتد و حفرهها را به سمت آند هدایت کرده و جداسازی بار را به شدت بهبود میبخشد.
-
کاهش ولتاژ مورد نیاز: این سیستم میتواند ولتاژ مورد نیاز برای انجام واکنشهای انرژیبر مانند تجزیه آب یا کاهش $\text{CO}_2$ را کاهش دهد، زیرا بخشی از انرژی مورد نیاز توسط فوتونها تأمین میشود.
-
افزایش ظرفیت جذب: با اعمال پتانسیل مناسب، میتوان "نوار جذب" کاتالیزور را به سمت نور مرئی شیفت داد یا از پدیدههای جذب ثانویه استفاده کرد.
واکنشهای کلیدی در فوتوالکتروکاتالیز
-
فوتوالکترولیز آب: استفاده از سلولهای فتوکاتالیستی (مانند سلولهای بیپارامتری که در آن یک نیمههادی آندی و دیگری کاتدی است) برای تولید $\text{H}_2$ و $\text{O}_2$ فقط با نور خورشید و بدون نیاز به جریان خارجی.
-
کاهش فوتوالکتروشیمیایی $\text{CO}_2$: این فرآیند با استفاده از نور، $\text{CO}_2$ را به سوختهایی مانند فرمیک اسید یا مونوکسید کربن تبدیل میکند، که این امر نیازمند دقت بالا در طراحی الکترود است.
چالشها و افقهای پیش رو
با وجود پتانسیل شگرف کاتالیزورهای نوری و الکتروشیمیایی در گذار به انرژی پاک، چندین چالش اساسی وجود دارد که باید برای تحقق کاربردهای تجاری حل شوند:
1. پایداری و طول عمر (Stability and Durability)
پایداری یکی از بزرگترین موانع است، به ویژه در محیطهای فعال واکنش:
-
در فوتوکاتالیز: گونههای فعال رادیکالی (مانند $\cdot \text{OH}$) که برای تخریب آلایندهها استفاده میشوند، میتوانند به سرعت ساختار کاتالیزور نیمههادی را مورد حمله قرار داده و باعث تخریب سطح آن شوند (Photocorrosion).
-
در الکتروکاتالیز: الکتروکاتالیستها، به ویژه آنهایی که برای OER طراحی شدهاند (مانند ترکیبات نیکل و کبالت)، در محیطهای شدیداً قلیایی یا اسیدی دچار خوردگی شده و ساختار خود را از دست میدهند.
2. هزینه و فراوانی مواد (Cost and Abundance)
وابستگی شدید به فلزات نجیب مانند پلاتین، پالادیوم، و ایریدیوم در بسیاری از فرآیندهای کلیدی، مانع از مقیاسپذیری اقتصادی این فناوریها میشود. دستیابی به تولید هیدروژن سبز در مقیاس گیگاوات نیازمند جایگزینهای ارزانقیمت است.
راه حلهای پیشنهادی:
-
مهندسی دقیق ساختار نانو (Nanostructure Engineering): ساخت نانوذرات، نانوسیمها یا نقاط کوانتومی برای افزایش سطح فعال و بهبود انتقال الکترونها، حتی با بارگذاری کم فلز نجیب.
-
طراحی کاتالیزورهای غیر نجیب (Non-precious Metal Catalysts - NPMCs): توسعه سیستمهای مبتنی بر آهن، نیکل، کبالت و مس که بتوانند با فلزات نجیب رقابت کنند.
3. سینتیک و بازده تبدیل (Kinetics and Efficiency)
در فوتوکاتالیز، نرخ تولید زوج الکترون-حفره اغلب پایین است و بازده کوانتومی (Quantum Yield) کمی دارند. در الکتروکاتالیز، ولتاژ اضافی (Overpotential) مورد نیاز برای OER بسیار بالاست که بازده کلی سیستمهای الکترولایزر را کاهش میدهد. بهینهسازی سینتیکهای سطحی برای کاهش این انرژیهای اضافی حیاتی است.
نتیجهگیری
کاتالیزورهای نوری و الکتروشیمیایی نماینده جهشی پارادایمی در حوزه شیمی انرژی هستند که در آن فرآیندهای شیمیایی از وابستگی به حرارت خارج شده و به سمت فرآیندهای مبتنی بر نور و الکتریسیته هدایت میشوند. فوتوکاتالیز از فراوانی نور خورشید برای تبدیل مستقیم آلایندهها یا تولید سوخت استفاده میکند، در حالی که الکتروکاتالیز کنترل دقیقی بر واکنشها از طریق انرژی الکتریکی فراهم میآورد. همگرایی این دو حوزه در فوتوالکتروکاتالیز، افقهای جدیدی را برای افزایش بازده و کاهش انرژی مورد نیاز باز میکند.
موفقیت در غلبه بر چالشهای پایداری و هزینه این سیستمها، به ویژه از طریق توسعه کاتالیزورهای نوآورانه مبتنی بر مواد فراوان و مهندسی شده در مقیاس نانو، مسیر را برای یک اقتصاد انرژی کاملاً سبز، پایدار و کربنخنثی هموار خواهد کرد. این دو ستون، بنیانهای اصلی نسل بعدی فناوریهای تبدیل و ذخیره انرژی پاک محسوب میشوند.
راه های ارتباطی:
09120181231
02178994682
www.dezhave-shop.ir
www.dezhave.com

کامنت0
کامنت بگزارید